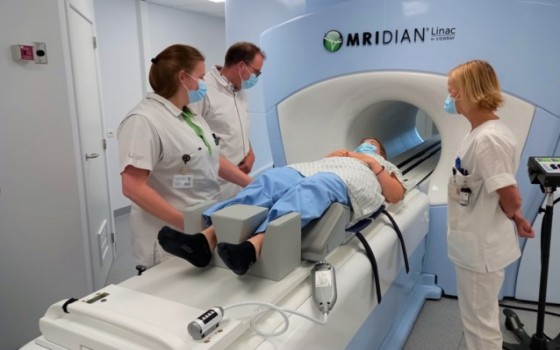
بروكسل : قواعد جديدة تضمن توفر التكنولوجيات الصحية المبتكرة والفعّالة للمرضى في جميع أنحاء الاتحاد الأوروبي

- Europe and Arabs
- الجمعة , 10 يناير 2025 13:16 م GMT
بروكسل : اوروبا والعرب
اعتبارا من يوم الأحد الموافق 12 يناير، ستصبح لائحة تقييم التكنولوجيا الصحية سارية المفعول، مما سيحقق تحسنًا كبيرًا في ضمان توفر التكنولوجيات الصحية المبتكرة والفعّالة للمرضى في جميع أنحاء الاتحاد الأوروبي.
وقال بيان صدر عن المفوية الاوروبية في بروكسل الجمعه "تخلق القواعد الجديدة إطار عمل للاتحاد الأوروبي لتقييم التكنولوجيات الصحية، مثل الأدوية والأجهزة الطبية، من خلال تعزيز التعاون والتنسيق بين الدول الأعضاء في الاتحاد الأوروبي. سيساعد هذا السلطات الوطنية على اتخاذ قرارات أكثر دقة واستنارة بشأن تسعير وتعويض التكنولوجيات الصحية وتبسيط إجراءات مطوري التكنولوجيا الصحية. سيساهم هذا في الوصول الأسرع والأوسع إلى المنتجات المبتكرة الجديدة والأكثر فعالية للمرضى.
ستطبق القواعد على الشركات التي تسعى للحصول على ترخيص تسويق لمنتجاتها من خلال تقديم إطار عمل جديد ودائم للاتحاد الأوروبي لتقييم التكنولوجيا الصحية، بما في ذلك من خلال:
إدخال ملف تقديم واحد على مستوى الاتحاد الأوروبي للتقييمات السريرية المشتركة من أجل ضمان تجميع الموارد على مستوى الاتحاد الأوروبي وتعزيز الجودة العلمية لتقييم التكنولوجيا الصحية في جميع أنحاء الاتحاد الأوروبي مع تجنب تكرار التقييمات على المستوى الوطني.
إنشاء إجراءات أسرع تتطلب استكمال التقييمات السريرية المشتركة في غضون 30 يومًا بعد ترخيص الدواء؛
التشاور المنهجي للمرضى والأطباء أثناء إعداد التقييمات بالإضافة إلى إشراك واستشارات أصحاب المصلحة في تقييم التكنولوجيا الصحية.
كخطوة أولى، بدءًا من 12 يناير، ستطبق هذه القواعد الجديدة على طلبات ترخيص التسويق لدواء جديد لعلاج السرطان أو منتج دوائي للعلاج المتقدم (ATMP). سيتم تمديد القواعد لتشمل الأدوية اليتيمة في يناير 2028 وستغطي جميع المنتجات الطبية الجديدة اعتبارًا من عام 2030. سيتم أيضًا تقييم الأجهزة الطبية عالية الخطورة المحددة اعتبارًا من عام 2026.
يحل الإطار الجديد للاتحاد الأوروبي محل التعاون القائم على المشاريع الممول من الاتحاد الأوروبي بين الدول الأعضاء بشأن تقييم التكنولوجيا الصحية، مع احترام مسؤولية الدول الأعضاء بشكل كامل عن إدارة خدماتها الصحية وفقًا لما يتطلبه سياقها الوطني.
جدي بالذكر ان تقييم التكنولوجيا الصحية هو عملية علمية قائمة على الأدلة تهدف إلى إعلام إنشاء سياسات صحية آمنة وفعالة من خلال تلخيص المعلومات حول القضايا الطبية والاجتماعية والاقتصادية والأخلاقية المتعلقة باستخدام التكنولوجيا الصحية.
واعتمدت المفوضية الأوروبية مقترحها بشأن لائحة تقييم التكنولوجيا الصحية في 31 يناير 2018. وقد دخلت اللائحة، التي اعتُمدت في ديسمبر 2021، وهي أحد النتائج الرئيسية لاستراتيجية الأدوية في الاتحاد الأوروبي، حيز التنفيذ في يناير 2022. وهي تنطبق اعتبارًا من 12 يناير 2025. وخلال هذه الفترة الانتقالية التي استمرت ثلاث سنوات، استعدت المفوضية والدول الأعضاء من خلال إنشاء هيكل الحوكمة اللازم وصياغة الوثائق التحضيرية لدعم التطبيق الفعال.









لا يوجد تعليقات